دانلود مقاله ساختار و عملکرد حامل های میتوکندری– نقش مارپیچ گذرنده از غشاء Pو باقیمانده های Gدر مکانیسم های دریچه و انتقال
تعداد کلمات فایل انگلیسی :6240 کلمه 9صفحه pdf
تعداد صفحات فایل ترجمه:26 صفحه word فونت 14 B Nazanin+ Regular
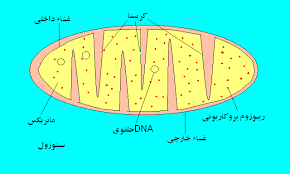
پروتئین غشایی، حامل میتوکندریایی، بیماری حامل میتوکندریایی،
ساختار و عملکرد حامل های میتوکندری– نقش مارپیچ گذرنده از غشاء Pو باقیمانده های Gدر مکانیسم های دریچه و انتقال
چکیده
تا به امروز 22 زیرخانواده حامل میتوکندریایی،براساس مشخصات سوبسترایی از لحاظ عملکردی شناسایی شده است. مطالعات ساختاری، عملکردی و بیوانفورماتیکی به حضور یک مکان اتصال سوبسترابالا خانواده حامل میتوکندریاییدر حفره حامل داخلی، دو شبکه یا دریچه پل نمکی،اشاره کردندکه بطور متناوب حفره را بر روی ماتریکس یا در سمت سیتوزولی غشاء می بندند، و پرولین و گلیسین رادر مارپیچ های آلفا گذرنده از غشاء حفاظت می کنند. اهمیت این خصوصیات در تغییرات ساختاری که در طول سیکل یا چرخه ترانسلوکیشن (جابجایی) سوبسترا کاتالیزوری رخ می دهد، در زمینه ی مدل مکانیسم حمل و نقل، مورد بحث قرار گرفته است. اکثر جهش های تولید شده از لحاظ تجربی و بدمعنا شده به دلیل بیماری، در مناطق حامل مربوط بهمکان های اتصال سوبسترا دو دریچه و پرولین و گلیسین حفاظت شده، نگران کننده هستند.
کلیدواژه ها: پروتئین غشایی، حامل میتوکندریایی، بیماری حامل میتوکندریایی، پرولین و گلیسین حامل میتوکندریایی، ساختار انتقال دهنده یا ترانسپورتر، مکانیسم انتقالی
- مقدمه
حامل های میتوکندریایی (MCs)، پروتئین های غشایی کدشده توسط هسته هستند که انواعی از املاح را (دی و تری کربوکسیلات، کتواسیدها، آمینواسیدها، نوکلئوتیدها و کوآنزیم/کوفاکتور) در سراسر غشای داخلی میتوکندری انتقال می دهند (برای مرور (1،2) را ببینید). MCsعلاوه بر ایجاد یک رابط میان میتوکندری و محفظه های سلولی دیگر، نقشی را در تنظیم و حفظ تعادل میان سیتوزول و ماتریکس میتوکندری بازی می کند برای مثال فسفوریلاسیون و پتانسیل ردوکس (یا پتانسیل اکسیداسیون و احیا).برخی حامل ها یا یکی از ایزوفرم های آنها در صورت وجود، بطور گسترده ای در تمام یا نزدیک تمام بافت ها، توزیع می شوند،
Structure and function of mitochondrial carriers – Role of the transmembrane helix P and G residues in the gating and transport mechanism
Ferdinando Palmieri *, Ciro Leonardo Pierri
ABSTRACT
To date, 22 mitochondrial carrier subfamilies have been functionally identified based on substrate specificity. Structural, functional and bioinformatics studies have pointed to the existence in the mitochondrial carrier superfamily of a substrate-binding site in the internal carrier cavity, of two salt-bridge networks or gates that close the cavity alternatively on the matrix or the cytosolic side of the membrane, and of conserved prolines and glycines in the transmembrane a-helices. The sig¬nificance of these properties in the structural changes occurring during the catalytic substrate trans-location cycle are discussed within the context of a transport mechanism model. Most experimentally produced and disease-causing missense mutations concern carrier regions corre¬sponding to the substrate-binding site, the two gates and the conserved prolines and glycines. © 2009 Federation of European Biochemical Societies. Published by Elsevier B.V. All rights reserved.
Keywords:
Membrane protein
Mitochondrial carrier
Mitochondrial carrier disease
Mitochondrial carrier proline and glycine
Transporter structure
Transport mechanism
کد:9514
دانلود رایگان مقاله انگلیسی
رمز فایل :www.downloadmaghaleh.com



توضیحات محصول
دانلود مقاله ساختار و عملکرد حامل های میتوکندری– نقش مارپیچ گذرنده از غشاء Pو باقیمانده های Gدر مکانیسم های دریچه و انتقال
تعداد کلمات فایل انگلیسی :6240 کلمه 9صفحه pdf
تعداد صفحات فایل ترجمه:26 صفحه word فونت 14 B Nazanin+ Regular
پروتئین غشایی، حامل میتوکندریایی، بیماری حامل میتوکندریایی،
ساختار و عملکرد حامل های میتوکندری– نقش مارپیچ گذرنده از غشاء Pو باقیمانده های Gدر مکانیسم های دریچه و انتقال
چکیده
تا به امروز 22 زیرخانواده حامل میتوکندریایی،براساس مشخصات سوبسترایی از لحاظ عملکردی شناسایی شده است. مطالعات ساختاری، عملکردی و بیوانفورماتیکی به حضور یک مکان اتصال سوبسترابالا خانواده حامل میتوکندریاییدر حفره حامل داخلی، دو شبکه یا دریچه پل نمکی،اشاره کردندکه بطور متناوب حفره را بر روی ماتریکس یا در سمت سیتوزولی غشاء می بندند، و پرولین و گلیسین رادر مارپیچ های آلفا گذرنده از غشاء حفاظت می کنند. اهمیت این خصوصیات در تغییرات ساختاری که در طول سیکل یا چرخه ترانسلوکیشن (جابجایی) سوبسترا کاتالیزوری رخ می دهد، در زمینه ی مدل مکانیسم حمل و نقل، مورد بحث قرار گرفته است. اکثر جهش های تولید شده از لحاظ تجربی و بدمعنا شده به دلیل بیماری، در مناطق حامل مربوط بهمکان های اتصال سوبسترا دو دریچه و پرولین و گلیسین حفاظت شده، نگران کننده هستند.
کلیدواژه ها: پروتئین غشایی، حامل میتوکندریایی، بیماری حامل میتوکندریایی، پرولین و گلیسین حامل میتوکندریایی، ساختار انتقال دهنده یا ترانسپورتر، مکانیسم انتقالی
حامل های میتوکندریایی (MCs)، پروتئین های غشایی کدشده توسط هسته هستند که انواعی از املاح را (دی و تری کربوکسیلات، کتواسیدها، آمینواسیدها، نوکلئوتیدها و کوآنزیم/کوفاکتور) در سراسر غشای داخلی میتوکندری انتقال می دهند (برای مرور (1،2) را ببینید). MCsعلاوه بر ایجاد یک رابط میان میتوکندری و محفظه های سلولی دیگر، نقشی را در تنظیم و حفظ تعادل میان سیتوزول و ماتریکس میتوکندری بازی می کند برای مثال فسفوریلاسیون و پتانسیل ردوکس (یا پتانسیل اکسیداسیون و احیا).برخی حامل ها یا یکی از ایزوفرم های آنها در صورت وجود، بطور گسترده ای در تمام یا نزدیک تمام بافت ها، توزیع می شوند،
Structure and function of mitochondrial carriers – Role of the transmembrane helix P and G residues in the gating and transport mechanism
Ferdinando Palmieri *, Ciro Leonardo Pierri
ABSTRACT
To date, 22 mitochondrial carrier subfamilies have been functionally identified based on substrate specificity. Structural, functional and bioinformatics studies have pointed to the existence in the mitochondrial carrier superfamily of a substrate-binding site in the internal carrier cavity, of two salt-bridge networks or gates that close the cavity alternatively on the matrix or the cytosolic side of the membrane, and of conserved prolines and glycines in the transmembrane a-helices. The sig¬nificance of these properties in the structural changes occurring during the catalytic substrate trans-location cycle are discussed within the context of a transport mechanism model. Most experimentally produced and disease-causing missense mutations concern carrier regions corre¬sponding to the substrate-binding site, the two gates and the conserved prolines and glycines. © 2009 Federation of European Biochemical Societies. Published by Elsevier B.V. All rights reserved.
Keywords:
Membrane protein
Mitochondrial carrier
Mitochondrial carrier disease
Mitochondrial carrier proline and glycine
Transporter structure
Transport mechanism
کد:9514
دانلود رایگان مقاله انگلیسی
رمز فایل :www.downloadmaghaleh.com